桑庆/匡延平/王磊团队发现并命名了人类新遗传病-卵子死亡,并明确了致病基因并揭示了机制
3月28日,Science子刊 《科学 转化医学》(Science Translational Medicine)(5年平均IF=18.6)发表了人类遗传学与人类学系桑庆、王磊团队,联合上海交通大学医学院附属第九人民医院生殖中心匡延平团队的最新研究成果“APannexin 1 Channelopathy Causes Human Oocyte Death”。首次发现了一种全新的临床疾病,将其命名为“卵子死亡”。在四个独立家系中,发现了细胞连接蛋白家族成员PANX1存在不同的突变,通过细胞水平、爪蟾卵子、鼠模型等多个角度深入揭示了致病机制:突变通过影响蛋白糖基化、激活通道、加速ATP释放,致表型出现,从而证明了卵子死亡是一种全新的孟德尔遗传病及糖基化疾病,也是PANX家族成员异常的首个离子通道疾病。

Pannexin与Connexin家族是形成细胞之间连接的重要离子通道,它们控制的信号通路在细胞正常生理作用中发挥关键的作用。Connexin(Cx)家族包括21个成员,其中一些成员发生突变已被发现引起诸多疾病。例如,Cx32突变导致神经系统疾病Charcot-Marie-Tooth(Science,1993),Cx26,Cx31,Cx30突变导致听力障碍(Nature, 1997;Nature Genetics,1998;Nature Genetics, 1999),Cx46突变致白内障(Am J Hum Genet,1999)等。Pannnexin(PANX)家族由三个成员PANX1,2,3组成。迄今尚未发现任何疾病由此三个成员突变导致。PANX1在2003年被克隆, 随后的十余年间,大量研究报道其与炎症、感染、局部缺血等生理病理学过程有关,但是,未有PANX1突变引起人类疾病的报道。PANX1敲除鼠可育,也不存在其他器官的异常。这些证据似乎又表明PANX1并不重要。
研究首先发现了一种此前从未被报道过的,导致女性不孕及试管婴儿反复失败的全新临床表型:某些患者卵子取出体外放置一段时间或受精后一段时间,出现退化凋亡的现象,将其命名为“卵子死亡”。在四个独立家系中,发现了PANX1存在不同的突变, 明确了此表型符合孟德尔显性遗传特点,证明了卵子死亡是一种全新的孟德尔显性遗传。PANX1为糖基化蛋白,随后在细胞及卵子中的系列功能实验证明:突变会改变PANX1的糖基化模式,被改变的糖基化模式与疾病密切相关,表明卵子死亡亦属于一种新的糖基化疾病。通过体外鼠卵子、爪蟾卵子研究显示:突变引起PANX1通道异常激活,加速了卵子内部ATP释放,导致疾病出现。有趣的是,四个PANX1 Knock-in突变鼠的生育力均正常且无明显表型。随后发现PANX1在人卵中的表达显著高于鼠卵,推测这可能是突变鼠无表型的原因。进一步制作了在卵子特异表达的野生型及突变型PANX1过表达鼠模型。鼠模型表现为不孕,且准确模拟出了卵子死亡的表型(图1)。此研究发现了人类新的孟德尔遗传病、糖基化疾病及离子通道疾病-卵子死亡;揭示了PANX1突变致疾病产生并明确了致病机制;同时也提供了首个深入研究PANX1病理学功能的鼠模型。
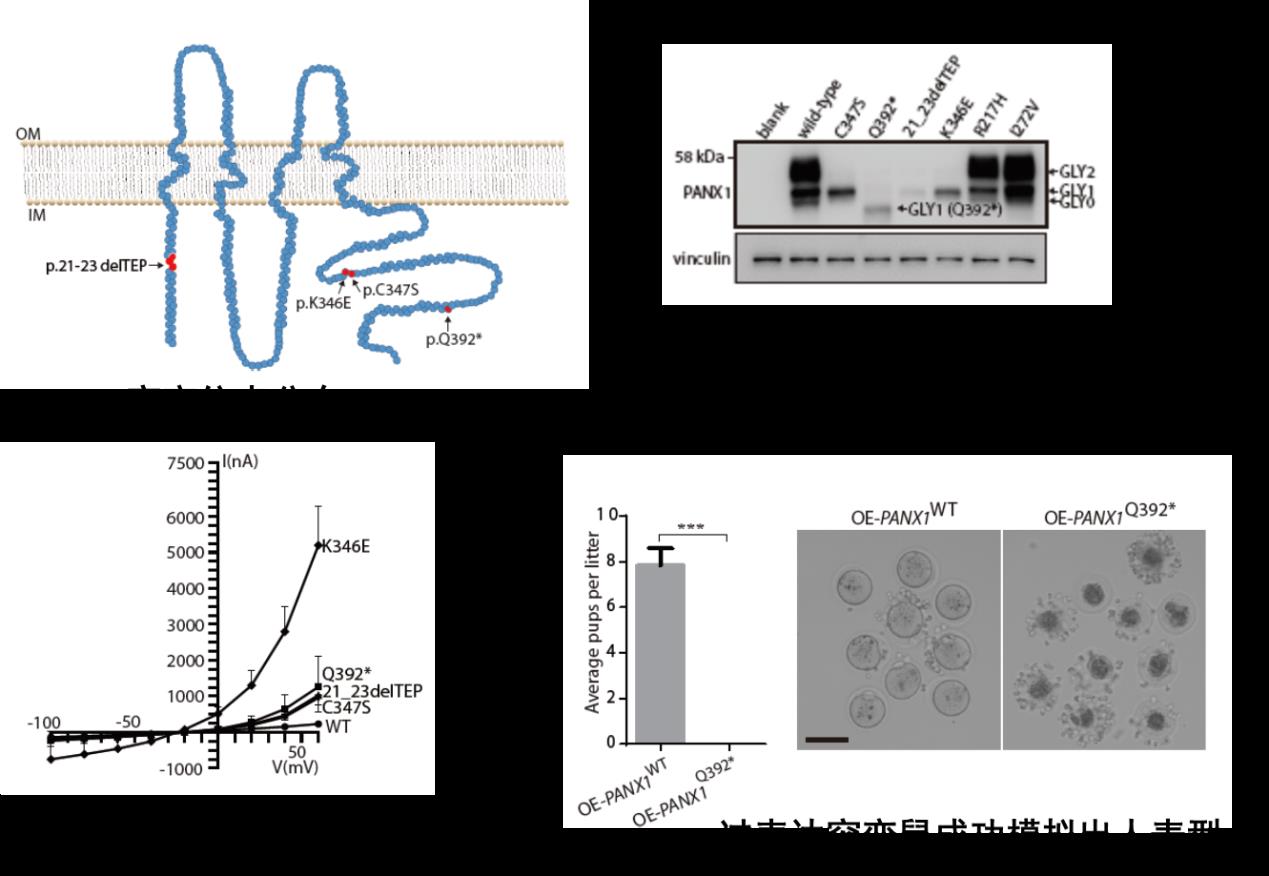
图1:PANX1突变位点分布及功能机制研究
桑庆副研究员、王磊教授、匡延平教授为本论文的通讯作者。复旦生物医学研究院博士研究生张治华、西北妇女儿童医院师娟子教授,复旦大学附属红房子医院孙晓溪教授、九院生殖中心李斌、闫铮博士为共同第一作者。中科院神经所竺淑佳团队,孙强研究员亦参与了此项研究。
桑庆、王磊团队联合其他研究者近几年关注于人类早期生殖异常的遗传学基础,相继在N Engl J Med (2016), ScienceTransl Med (2019), Am J Hum Genet(2016,2017,2018)等发表论文。陆续发现了此过程中的2种新孟德尔遗传病、5个新致病基因并阐明了部分基因的机制(图2)。扩展了对人类孟德尔疾病的认知;揭示了人类卵子及早期胚胎发育中隐藏着大量前所未知的新基因;同时,也为相关患者的遗传咨询及实现辅助生殖中的精准医学实践奠定了基础。
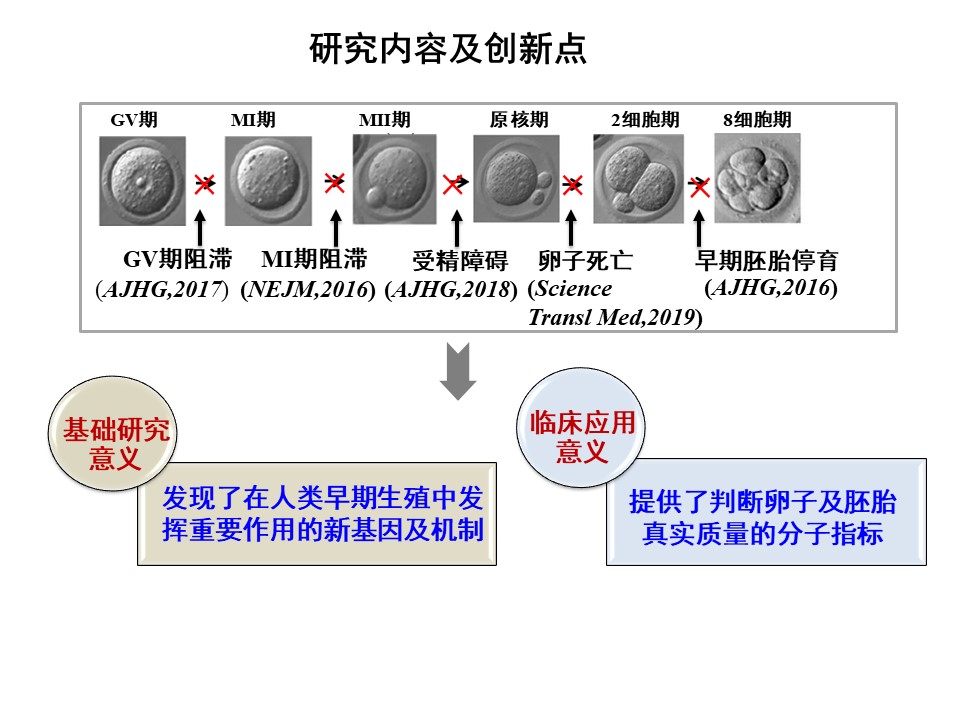
图2:导致卵子、受精及早期胚胎发育异常的致病基因
论文全文链接:http://stm.sciencemag.org/content/11/485/eaav8731


